摘要
背景
与自然过程相比,手术诱导的绝经妇女具有更高的骨质损失率。本研究旨在在手术诱导绝经后评估雌二醇符号的早期治疗骨周转标志物。
方法
这项前瞻性研究包括41名因妇科良性疾病行子宫切除和卵巢切除的绝经前和围绝经期妇女。手术后两周,所有参与者评估更年期激素治疗(MHT)指征。有适应证并接受治疗者,给予雌激素治疗(激素治疗组)。其他没有MHT适应症的人被分配到无治疗组。测量术前和术后12周的血清CTX和P1NP水平,并将其作为主要结果。同组患者手术绝经前后血清CTX、P1NP采用Wilcoxon秩和检验。采用ANCOVA对两组手术绝经后12周血清CTX和P1NP进行比较。Spearman秩相关系数分析分析了年龄与基线骨转换标志物之间的相关性。一个p-值< 0.05认为有统计学意义。
结果
术后12周,激素治疗组的血清CTX和P1NP水平与基线相比无显著差异。相反,未接受激素治疗的妇女的血清CTX和P1NP水平显著升高(p-value分别< 0.001和0.002)。12周时两组血清CTX和P1NP有显著差异(p-value分别< 0.001和0.004)。
结论
早期雌激素口服戊酸雌二醇可明显抑制手术诱导的绝经期妇女的高骨重塑。
试验注册泰国临床试验注册中心标识号TCTR20190808004,自2019-08-08起回顾性注册。http://www.thaiclinicaltrials.org/show/TCTR20190808004.
背景
骨质疏松症是绝经后妇女最重要的健康风险之一。骨质疏松性骨折,特别是髋部骨折,发病率和死亡率高[1].绝经后骨质疏松症的主要决定因素是峰值骨量状态和持续骨质流失率[2,3.].绝经期雌激素缺乏是加速骨质流失的主要原因。在此阶段,骨形成和骨吸收的解耦导致雌激素介导的骨吸收抑制的衰竭[4].
自然绝经是一个老龄化过程,泰国妇女的年龄为49.5岁,西方人口的年龄约为52岁[5].它的定义是月经持续停止超过12个月,并发生在卵巢卵泡衰竭时。在最后一次月经前大约2-3年,雌激素逐渐下降,同时卵泡刺激素(FSH)升高。
与此相反,在自然绝经期开始之前手术切除双侧卵巢会导致卵巢激素的突然丧失,包括雌激素、黄体酮和睾酮[6,7].可能的证据表明,手术绝经与长期的不利健康后果有关,如骨量低、心血管疾病、认知障碍和总体死亡率的增加[8,9].尽管如此,50岁左右的围绝经期或绝经前妇女在进行子宫切除术时仍定期进行双侧卵巢切除术(至少在一些国家是这样)。目前,在大体发现卵巢的情况下,卵巢切除术预防卵巢癌的概念一直存在争议[10].我们的团队关注这个有争议的问题,特别是在可能的不必要的卵巢切除术后的急性骨丢失。我们的目的是评估手术绝经后的动态骨状态(骨重塑)和雌激素治疗对这种情况的保护作用。
骨重建是一个由骨吸收(破骨活性)和骨形成(成骨活性)引起的动态过程。在重建过程中,几个骨转换标记物被释放。骨转换标记物主要分为两大类:骨吸收标记物和骨形成标记物。在临床实践和研究中最常用的骨吸收标志物是交联度-终端端肽的类型我胶原蛋白(CTX)和n端(NTX)。相反,骨特异性碱性磷酸酶(BAP)、骨钙素、1型前胶原n端前肽(P1NP)和1型前胶原c端前肽(P1CP)可作为骨形成标志物[11].由于这些骨转换标志物的分析差异和应用局限性,国际骨质疏松基金会(IOF)和国际临床化学与检验医学联合会(IFCC)建议在临床实践中仅使用血清P1NP和CTX作为骨形成和骨吸收标志物[12].
自然绝经妇女骨重塑过程的加速导致血清骨形成和骨吸收标志物水平升高,骨矿物质密度(BMD)降低[13].另一方面,外科绝经期雌激素水平的突然和显著下降更为明显。骨密度测量检测到的骨丢失比自然过程中受到的影响更大[14].与自然绝经的妇女相比,手术诱发的绝经妇女的骨重建和骨丢失率相对较高[15].
绝经激素治疗(MHT)被批准用于至少1 / 4的绝经妇女,包括缓解令人困扰的血管舒缩症状,预防骨折高危妇女骨丢失,过早雌激素降低,和更年期泌尿生殖综合征[16]MHT方案分为两种主要类型,雌激素单独治疗和雌激素-孕激素治疗。子宫切除的更年期妇女首选雌激素单独疗法。在非子宫切除的更年期妇女中,建议使用雌激素-孕激素方案。MHT方案中孕激素的主要目的是保护子宫内膜[16]因为单独使用雌激素方案的非子宫切除妇女发生子宫内膜增生和子宫内膜癌的几率显著增加[17,18].然而,目前的证据表明,使用雌激素-孕激素方案的女性患乳腺癌和静脉血栓的风险高于单独使用雌激素方案[19,20.].由于这些原因,单独使用雌激素是经子宫切除术的更年期妇女的最佳选择。
本研究的主要目的是评估早期雌激素单独治疗与口服戊酸雌二醇对绝经手术后骨转换标记物(CTX和P1NP)水平的影响。在我们的研究中选择这种形式的雌激素的原因是,在一些国家有这种药物,成本低廉,并且戊酸雌二醇可以通过胃肠道酶代谢成17β-雌二醇,剂量效应相当。2 mg戊酸雌二醇的考虑主要基于文献中推荐的中等至高剂量雌二醇[21].然而,全球剂量有低、中、高三种不同[22].
方法
设计
该研究设计为一项单中心前瞻性试验,于2019年6月至2020年4月在泰国朱拉隆功国王纪念医院进行。本研究由朱拉隆功大学医学院机构审查委员会IRB 009/62批准,泰国临床试验注册委员会审查,并前瞻性批准注册2019-08-08和泰国临床试验注册识别号TCTR20190808004。向所有登记的参与者提供了有关该研究的信息。在研究开始前,从所有参与者处获得书面知情同意书。
纳入和排除标准
所有40-55岁的绝经前和围绝经期妇女计划在泰国朱拉隆功国王纪念医院进行子宫切除术和双侧卵巢切除术。在这项研究中,参与者的月经模式决定了绝经状态的定义。本研究中绝经前女性的定义为在参与研究前6个月有正常月经周期的女性。在过去一年中,月经间隔超过35天且占总周期至少50%的女性被归类为围绝经期。排除标准为闭经3个周期或6个月以上继发性闭经,入组前3个月内有性激素或糖皮质激素使用史的女性。有影响骨转换指标的病史或已知的任何疾病(包括甲状腺疾病、甲状旁腺、肾功能不全和12个月内近期骨折)的女性也被排除在外。有一个以上特殊MHT禁忌症(如冠心病、中风、静脉血栓形成、乳腺癌或子宫内膜癌、先天性血栓形成)的妇女被忽略。
样本大小的理由
样本量采用两相依平均数公式计算。研究使用了之前一项研究的数据[23,24].公式中α = 0.05, β = 0.1。本研究的计算样本量为18名参与者。当我们纳入20%辍学率时,两项依赖试验所需的总样本量为21人。我们的目的是分析激素治疗组与未治疗组的骨转换标记物作为次要目标。招募了同样数量的未接受激素治疗的参与者。
数据收集和干预
收集人口统计资料。血清CTX、P1NP和FSH在择期子宫切除伴卵巢切除术前约7-10天获得(基线骨转换指标)。在夜间禁食至少8小时后,于上午8点至9点采血。采用电化学发光免疫分析法(Elecsys试剂盒,罗氏诊断泰国)测定血清CTX、P1NP和FSH。血清CTX、P1NP和FSH的变异系数(CV)分别为3.8%、2.3%和3.8%。检测血清CTX、P1NP和FSH的CV分别为2.1%、1.8%和1.5%。
手术后两周,所有参与者的适应症由生殖内分泌学家评估。参与者根据其症状和MHT适应症被分为治疗组或无治疗组。主要研究人员向有更年期激素治疗适应症的参与者咨询激素治疗的风险和益处。有MHT适应症并对治疗感兴趣的参与者被分配到激素治疗组。他们在手术后2周开始口服戊酸雌二醇2 mg/片,每天1片(Progynova®片,拜耳泰国,泰国),共12周。没有MHT适应症的参与者被分配到无治疗组。在12周结束时,以相同的程序获得血液作为基线。所有的实验室测量数据都是在最后一片药丸服用后的第二天收集的。
成果计量
主要结果为各组术前、术后血清CTX水平的比较。次要结果是比较激素组和无激素组术后12周CTX和P1NP水平。其他结果是比较各组患者术前、术后血清P1NP水平。最后,我们分析了手术绝经年龄与基线血清CTX和P1NP的相关性。
统计分析
IBM SPSS™ 统计数据版本22.0 for Windows用于统计分析。采用描述性统计方法呈现基线数据。采用Wilcoxon符号秩检验对手术绝经前后患者的中位血清CTX和血清P1NP进行比较。通过ANCOVA(年龄调整)分析两组患者手术绝经后12周的血清CTX和P1NP中位数的比较。Spearman秩相关系数分析分析了年龄与基线骨转换指标之间的相关性。数据的正态分布通过Kolmogorov–Smirnov检验进行检验。A.p-值< 0.05认为有统计学意义。
结果
研究参与者
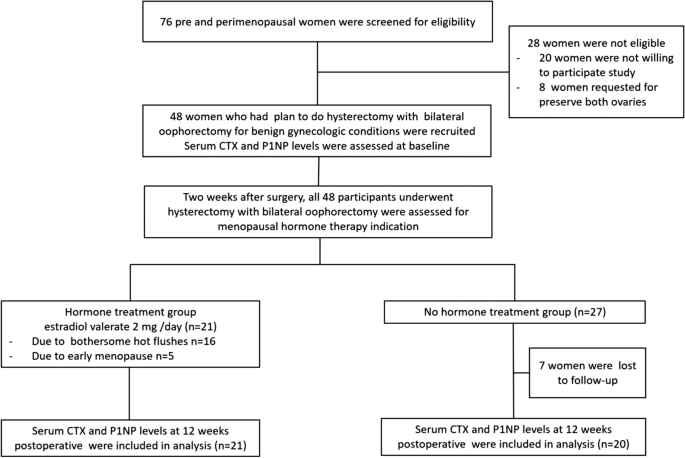
从2019年6月到2020年1月,评估了七十六个前和周末妇女的资格。二十八名妇女没有资格(20岁不愿意参加该研究,8名妇女要求保留两个卵巢)。共有48名女性符合纳入标准,愿意参加本研究。只有41名妇女在12周返回后续访问,并被列入分析。二十一名女性每天接受2毫克口服雌二醇素12周。在这种激素治疗组中,由于麻痹血管运动症状,16名女性接受了雌二醇毒剂,而其他6名参与者由于早期更年期(早熟的低生物化状态)而接受这种激素。这个群体没有参与者否认荷尔蒙治疗。这种激素治疗组的所有参与者共持续为12周的药物。没有MHT指示的其他人被分配给NO激素治疗组。初始注册中有27名女性; seven out of 27 were lost to follow-up. There was no participant in the no treatment group who received any MHT in the study period. Statistical analysis in this study included a total of 41 women who completed a 12-week follow-up period (21 women in the hormone treatment group and 20 women in the no hormone treatment group). The study flow is demonstrated in Fig.1.
参与者的基线特征见表1.两组年龄差异有统计学意义(p-价值观 = 激素治疗组妇女在基线检查时的血清CTX和P1NP水平中位数(IQR)分别为0.21(0.17–0.35)ng/ml和37.97(26.09–54.62)ng/ml。未治疗组妇女在基线检查时的血清CTX和P1NP水平中位数(IQR)分别为0.24(0.19–0.34)ng/ml和42.11(35.26–72.57)两组在基线检查时血清CTX和P1NP水平无统计学差异。
基线与双侧卵巢切除术后12周血清骨转换指标的比较
作为主要目标,对基线检查和术后12周之间的血清CTX和P1NP水平进行比较。在激素治疗组中,术后12周的血清CTX和P1NP水平中位数分别为0.21(0.14–0.34)ng/ml和42.41(31.42–63.61)基线检查和术后12周之间,CTX和P1NP水平没有显著差异(p-值分别为0.660和0.120)。数据见表2.
术后12周,无治疗组女性血清中位CTX和P1NP水平分别为0.47(0.28-0.65)ng/ml和63.63 (54.98-80.45)ng/ml。与激素组相比,未治疗组12周时血清CTX和P1NP水平显著高于基线(p-价值观 < 分别为0.001和0.002)。数据如表所示2.
激素治疗组与未治疗组子宫切除双侧卵巢切除术后12周血清骨循环指标比较
作为次要目标,我们分析了两组患者术后12周的骨转换指标。术后12周,激素治疗组患者血清CTX和P1NP水平分别为0.21 (0.14-0.34)ng/ml和42.41 (31.42-63.61)ng/ml。无治疗组患者血清CTX和P1NP水平分别为0.47 (0.28-0.65)ng/ml和63.63 (54.98-80.45)ng/ml。激素治疗组女性血清CTX和P1NP水平显著低于未治疗组(p-value < 0.001和0.004)。数据见表3..激素治疗组患者术后12周血清中位CTX和P1NP水平分别为未治疗组的55%和33%。
额外的相关分析
由于手术时参与者的年龄可能对骨转换标志物水平产生影响,我们分析了年龄和骨转换标志物之间的相关性。然而,在激素治疗组和未治疗组中,中位血清CTX与手术绝经年龄之间没有显著相关性,r = 0.28p-价值观 = 0.22和r = 0.14和p-value分别= 0.56。同样,在激素治疗组和未治疗组中,中位血清P1NP与手术绝经年龄之间无显著相关性,r =−0.01p-value = 0.97, r = 0.08p-value分别= 0.72。
激素治疗的不良反应
在所有参与者中没有显著的治疗不良事件。尽管开出了相对高剂量的雌激素,但没有出现临床血栓栓塞事件、胸痛、晕厥、严重胃肠道副作用或药物过敏。然而,激素治疗组的三名女性在雌激素启动几周后出现轻微的乳房疼痛。这种乳房疼痛症状无需药物治疗即可自行改善。这三名妇女继续雌激素治疗,直到12周的随访。
讨论
目前的研究表明,未接受雌激素治疗的手术绝经妇女的骨转换标志物显著升高。尽管时间很短,但术后3个月内出现无症状但显著高骨吸收过程。
骨重建由两种相反的活动组成:破骨细胞吸收旧骨和成骨细胞形成新骨。骨重塑的功能是替代旧骨、调节钙稳态、酸碱平衡、释放嵌入骨中的生长因子。在骨基本多细胞单位(BMU)水平上,骨重塑过程在时间和面积上紧密耦合[25].骨转换标记物在骨重建过程中释放到血液中,并提供有关骨骼状态的动态信息。
在骨吸收过程中,胶原蛋白被破骨细胞降解。CTX是I型胶原交联区的非螺旋状片段,由破骨细胞特异性蛋白酶组织蛋白酶K释放。天然的α型CTX经历自发的β异构化,这归因于蛋白质老化[26].它们在血液中循环,部分通过尿液排出。骨吸收有昼夜变化。CTX在BTMs中表现出最高的日波幅,在05.00 h达到峰值,在14.00 h达到最低点。摄入早餐可使血清CTX降低40% [25]胰高血糖素样肽的分泌可能介导了这种喂食效应[27].因此,必须在早晨空腹时(早上7点到10点之间)采集血液进行测量。对一些患者(如糖尿病患者)在临床实践中不可取,将就诊时间限制在上午预约。
在妇女绝经前手术切除双侧卵巢会导致循环雌激素水平突然下降[6].根据之前的一项研究,血清CTX在手术后一个月就会升高。血清CTX水平持续升高至术后6个月。此外,他们发现术前和术后6个月骨转换标志物水平与腰椎骨密度(BMD)之间存在显著负相关[14].在另一项研究中,绝经手术后3个月骨吸收和形成标记物升高。然而,在服用绝经激素3个月后,骨标志物水平下降到基线水平[23].
在骨形成标志物方面,我们根据IOF推荐标准选择血清P1NP作为结局指标。类骨由I型胶原组成,形成于骨形成的早期。前胶原蛋白是两条α1和一条α2链的三聚体。PINP是在I型胶原分子组装成纤维之前从前胶原分子分离出来的[28].虽然I型胶原蛋白不是特定于骨骼,但大多数循环PINP来源于它。P1NP释放到循环中,并提供了一些临床优势,包括低昼夜变化和在室温下的稳定性。此外,P1NP水平不受饮食摄入的显著影响,因此患者不需要禁食[27].在之前的一项研究中,即使在控制了年龄、BMI和绝经年限后,血清P1NP水平与腰椎、全髋关节和股骨颈的骨密度呈负相关。绝经后骨质疏松妇女的P1NP水平明显高于平均骨量妇女。然而,在临床实践中,它的低特异性并不保证在骨质疏松症诊断中的应用[29].
在育龄期,雌激素对于维持足够的骨量至关重要。骨吸收和骨形成受循环雌激素水平的调节和平衡。雌激素激活骨保护素(OPG)的合成,OPG是中和NF-ĸB配体受体激活剂(RANKL)并抑制RANK表达(RANKL受体)的诱饵抗体。对雌激素的反应会抑制破骨细胞的分化和活化。此外,雌激素调节促炎细胞因子,如IL-1、IL-6、TNF-α和PGE2,减少破骨细胞前体的数量。TGF-β表达导致破骨细胞凋亡[30.]根据上述所有机制,雌激素缺乏是骨生理的主要有害因素。此外,许多研究表明绝经激素治疗对绝经后妇女的骨转换标志物、骨密度和骨折预防有积极影响[31,32,33,34].
作为本研究的主要结果,激素治疗组在12周时的血清CTX和P1NP水平与基线相比没有显著变化。相反,未接受激素治疗的妇女的血清CTX和P1NP水平显著升高。换句话说,早期服用中剂量雌激素en可抑制急性雌激素剥夺引起的异常骨吸收。在次要转归中,两组患者在手术绝经后12周的血清CTX和P1NP水平存在统计学差异。与未治疗组相比,中位血清CTX水平降低55%具有统计学和临床意义。手术绝经后12周的时间激素起始可能是一个重要问题。在我们的研究中,激素治疗是在手术后2周左右开始的。相反,Peris等人的研究[23术后3个月开始激素治疗。我们的结果与Peris等人的发现之间的差异部分是由于绝经激素开始的时间。
值得注意的是,在我们的研究中,48名女性中有16人在卵巢切除术后2周就出现了中度至重度潮热。因此,对于有MHT适应症的女性,应尽快考虑使用MHT。在这种情况下,MHT的好处是改善生活质量和防止加速骨质流失。然而,一些临床医生可能担心MHT术后早期静脉血栓形成的风险,特别是在肥胖、代谢综合征和老年患者的情况下。在这些患者中,最佳剂量的雌激素经皮给药可将血栓风险降到最低。
在治疗效果方面,我们发现早期口服2 mg戊酸雌二醇明显抑制骨重建过程。然而,并不能对市场上所有的口服MHT产品做出结论。世界上很多产品都是1毫克雌二醇加多种黄体酮。低剂量的其他雌二醇产品和各种黄体酮的雌激素反作用可能会显著影响骨骼结果。
在本研究中,根据FDA批准的MHT适应症对每位参与者进行评估并将其分配到激素治疗组。16名中度至重度潮热的女性和5名手术时诊断为早期绝经的女性(年龄 < 虽然早期绝经与总体认知中的骨丢失有关,但在患者年龄的四分位之间,骨转换标记物浓度没有显著差异[29].据我们所知,没有研究证实潮热症状和骨转换标志物浓度之间存在直接联系。我们根据MHT适应症严格分配每个参与者到激素治疗组,以降低选择偏倚风险。所有的参与者和医生分配的治疗不知道基线骨转换标记水平在分配当天。
虽然骨转换标记物的升高与低骨密度和骨折风险增加有关,但在临床实践中解释骨转换标记物存在许多局限性。生物学上的观察者间变异、个体内变异、分析可靠性和定义不清的异常切点水平是临床应用中值得关注的问题。在解释结果时,应考虑并仔细考虑维生素D水平、阳光照射、过去12个月的骨折史、剧烈的体力活动和年份。此外,骨转换标志物的变化是骨代谢的唯一代表;它们不能用于诊断骨质疏松症。双能X线骨密度仪是临床实践和骨质疏松症研究中使用的标准方法。目前,骨转换标记物主要用于反应差、不依从治疗患者识别的患者[35],可作为双膦酸盐药物假期后重新开始治疗的指标[36].
在雌激素治疗和骨质疏松的数据解释和建议上存在不一致,尤其是绝经后骨质疏松。在50-60岁年龄组或绝经后10年内(机会之窗概念),MHT的好处最有可能超过任何风险。根据国际更年期学会(IMS)对妇女中年健康和更年期激素治疗的建议,MHT可被视为绝经后骨质疏松症的一线治疗方法[37].相反,北美的论文,美国临床内分泌学家协会/美国内分泌学会临床实践指南(AACE/ ACE) 2020绝经后骨质疏松症的诊断和治疗,指出雌激素从未被明确批准用于绝经后骨质疏松症。雌激素仅被美国食品和药物管理局批准用于预防绝经后骨质疏松症,且仅适用于骨质疏松症风险较大且非雌激素药物不合适的女性[38].
在子宫切除术时,传统的常规输卵管卵巢切除术应该重新进行,尤其是在绝经前和围绝经期妇女,因为一般人群中发生卵巢癌的终生风险仅为70分之一或1.4%[39],医生应该确保他们关于风险和益处的咨询是基于当前的证据。子宫切除术时输卵管卵巢切除术的显著潜在益处是降低卵巢癌风险、避免可能的疾病和未来的卵巢疾病手术。然而,这些潜在的好处必须与循环雌激素过早丧失的后果相平衡,包括骨质流失、潮热、认知障碍、性欲丧失和长期存活率[39].本研究强调了这一概念。在我们的队列中,49%(20/41)的女性没有因为令人烦恼的血管舒缩症状和绝经早期指征接受MHT治疗。这些女性在术后3个月就明显失去了骨骼。应考虑仔细的临床评估、改善生活方式以促进骨骼健康,以及骨密度和/或质量测量的长期随访。在本研究中,我们为患者提供了尽可能多的关于子宫切除术时输卵管卵巢切除术的风险和益处的信息。主要基于患者自主性,由参与者在医生提供充分信息的情况下做出输卵管卵巢切除术的决定。在我们作为泰国医学院中心的经验中,我们发现30–40%的高龄绝经前和围绝经期妇女接受并决定在良性妇科疾病子宫切除术时摘除卵巢。然而,骨测量仅在少数患者中提供。
最后,由于参与者年龄对基线骨质周转标记水平的可能影响,我们对年龄和骨质周转标记之间的相关性进行了额外的分析。然而,在激素治疗中的手术绝经时血清CTX和年龄之间没有显着相关性,没有治疗组,R = 0.28p-价值观 = 0.22和r = 0.14和p-value分别= 0.56。同样,在激素治疗组和未治疗组中,血清P1NP与手术绝经年龄之间均无显著相关性,r =−0.01p-value = 0.97, r = 0.08p-value分别= 0.72。
本研究存在局限性。作为非随机设计,我们无法匹配两组之间的基线预后因素。该研究类型无法消除选择偏差。在进一步研究中应考虑证明该假设的随机对照试验。因为骨转换标记物可由各种因素参与,如维生素D状态、阳光照射、剧烈的体力活动、患者的医疗数据和近期骨折史等,应予以记录并仔细考虑。
结论
早期雌激素口服戊酸雌二醇可明显抑制手术诱导的绝经妇女的高骨重塑过程。需要进一步的对照研究来证明和评估骨状态的其他方面,并进行长期随访。
数据和材料的可用性
本研究期间使用和/或分析的数据集可根据合理要求从相应作者处获得。
参考
- 1.
卡利·贾,汤普森·德,恩斯鲁德·KC,斯科特·JC,布莱克D.临床骨折后的死亡风险.骨质疏松症杂志2000;11:556-61。
- 2.
等。美国国家骨质疏松基金会关于峰值骨量发展和生活方式因素的立场声明:系统回顾和实施建议。现代康复。2016;27:1281 - 386。
- 3.
GD,骨骼a,老化的骨骼。Adv Exp Med Biol. 2019; 1164:153-60。
- 4.
Riggs BL, Khosla S, Melton LJ第三。更年期骨质疏松症的单一模型:雌激素缺乏导致绝经后女性的I型和II型骨质疏松症,并导致老年男性的骨丢失。骨矿工Res. 1998; 13:763-73。
- 5.
Chompootweeps,Tankeyoon M,Yamarat K,Poomsuwan P,Dusitsin N.曼谷泰国妇女的更年期年龄和更年期症状.成熟期.1993;17:63-71。
- 6.
卵巢切除术和激素替代治疗对垂体-性腺功能的影响。matuitas。1993;17:101-11。
- 7.
罗德里格斯M, Shoupe D.外科绝经。Endocrinol Metab clinin North Am. 2015; 44:531-42。
- 8.
Shuster LT, Gostout BS, Grossardt BR, Rocca WA。绝经前妇女预防性卵巢切除术与长期健康。更年期Int。2008;14:111-6。
- 9.
Faubion SS,Kuhle CL,Shuster LT,Rocca WA.过早或早期绝经的长期健康后果和管理考虑.更年期.2015;18:483-91。
- 10.
Asante A, Whiteman MK, Kulkarni A, Cox S, Marchbanks PA, Jamieson DJ。美国选择性卵巢切除术:趋势和住院并发症,1998-2006。比较。Gynecol。2010;116:1088 - 95。
- 11.
Hlaing TT, Compston JE。骨循环的生化标记物的使用和限制。Ann Clin Biochem. 2014; 51:189-202。
- 12.
Vasikaran S, Eastell R, Bruyere O, Foldes AJ, Garnero P, Griesmacher A,等。用于预测骨折风险和监测骨质疏松治疗的骨转换标志物:需要国际参考标准。现代康复。2011;22:391 - 420。
- 13.
Chapullat RD,Garnero P,Sornay Rendu E,Arlot ME,Claustrat B,Delmas PD.绝经前和围绝经期妇女骨丢失的纵向研究:围绝经期妇女骨丢失的证据.骨质疏松症杂志2000;11:493-8。
- 14.
Bahar S, Abali R, Guzel S, Bozkurt S, Guzel EC, Aral H,等。手术绝经妇女血清骨转换指标和骨密度急性变化的比较。《妇产科再生生物学杂志》2011;159:194-7。
- 15.
Yildiz A,Sahin I,Göl K,Taner Z,Ulutürk A,Biberoĝlu K.腰椎骨丢失率:自然绝经和手术诱导绝经之间的比较.国际妇科观察杂志,1996;55(2):153-9。
- 16.
TNHTPSAP。北美更年期协会激素治疗立场声明。更年期。2017;2017(24):728–53。
- 17.
Sjögrenll,mørchls,løkkegaarde.hormone替代疗法和子宫内膜癌的风险:系统审查。Maturitas。2016; 91:25-35。
- 18.
Furness S,Roberts H,Marjoribanks J,Lethaby A.绝经后妇女的激素治疗与子宫内膜增生风险。科克伦数据库系统修订版。2012https://doi.org/10.1002/14651858.CD000402.pub4.
- 19.
乳腺癌激素因素合作小组。更年期激素治疗的类型和时间与乳腺癌风险:全球流行病学证据的个体参与者荟萃分析。柳叶刀杂志,2019;394:1159–68。
- 20.
Manson JE, Chlebowski RT, Stefanick ML, Aragaki AK, Rossouw JE, Prentice RL等。妇女健康倡议随机试验中干预和延长停后阶段的更年期激素治疗和健康结果《美国医学协会杂志》上。2013; 310:1353 - 68。
- 21.
Jane FM, Davis SR.一个管理更年期的从业者工具包。更年期。2014;17(5):564 - 79。
- 22.
Panay N, Anderson RA, Nappi RE, Vincent AJ, Vujovic S, Webber L,等。卵巢功能不全:国际更年期学会白皮书。更年期。2020;23(5):426 - 46。
- 23.
Peris P,Alvarez L,Monegal A,Guañabens N,DuráN M,Pons F等。手术绝经和激素替代治疗后骨转换的生化标志物。骨。1999;25:349–53。
- 24.
Delmas PD,Ponnel B,Felsenberg D,Garnero P,Hardy P,Pilate C等。基质透皮17β-雌二醇预防绝经后早期妇女骨丢失的剂量范围试验。国际骨研究组。1999;24:517–23。
- 25.
Eastell R,Szulc P.骨转换标记物在绝经后骨质疏松症中的应用。柳叶刀糖尿病内分泌杂志。2017;5(11):908-13。
- 26.
骨转换标记物在骨质疏松症中的应用。中华风湿病杂志。2012;8(7):379-89。
- 27.
小丑JA, Hannon RA, Yap TS, Hoyle NR, Blumsohn A, Eastell R.摄食对骨转换标记物的影响及其对测量的生物变异性的影响。骨头。2002;30(6):886 - 90。
- 28.
骨转换:生物学和评估工具。最佳临床内分泌代谢实践。2018;32(5):725–38.
- 29.
Kučukalić-Selimović E, Valjevac A, Hadžović-Džuvo A. 1型前胶原n端前肽在绝经后妇女骨状况评估中的应用。中国基础医学杂志。2013;13(4):259-65。
- 30
雌激素调节骨吸收的机制。J clinj Invest. 2000; 106:1203-4。
- 31
作者单位:国家自然科学基金青年科学基金,项目负责人。接受激素替代治疗的绝经后妇女骨转换的标记物。临床化学检验医学。2001;39(5):414-7。
- 32.
生化指标的早期反应预测早期绝经后妇女在激素替代治疗期间骨量的长期反应。骨头。2000;26(6):561 - 9。
- 33.
罗森CJ, Chesnut CH 3,马利纳克,新泽西州。骨转换生化指标对绝经后早期接受激素替代或补钙治疗妇女骨密度的预测价值。临床内分泌代谢杂志。1997;82(6):1904-10。
- 34.
Cauley JA,Robbins J,Chen Z,Cummings SR,Jackson RD,LaCroix AZ,等。雌激素加孕激素对骨折风险和骨密度的影响:妇女健康倡议随机试验。J Am医学协会,2003年;290:1729–38.
- 35.
绝经后妇女骨质疏松症的药理学管理:内分泌学会指南更新。J clinical Endocrinol Metab. 2020; 105:587-94。
- 36.
Roberts J,Castro C,Moore AE,Fogelman I,Hampson G.双膦酸盐治疗后“药物假日”患者骨密度和骨转换的变化:现实生活中的临床设置.临床内分泌(Oxf).2016;84:509–15。
- 37.
Baber RJ, Panay N, Fenton A, IMS Writing Group. 2016 IMS关于女性中年健康和更年期激素治疗的建议。更年期。2016;19(2):109 - 50。
- 38.
Camacho PM, Petak SM, Binkley N, Diab DL, Eldeiry LS, Farooki A, et al.;美国临床内分泌学家协会/美国内分泌学会诊断和治疗绝经后骨质疏松临床实践指南-2020更新。内分泌实践。2020;26(增刊1):1 - 46。
- 39.
妇产科。ACOG实践公告第89号。选择性和降低风险的输卵管卵巢切除术。比较。Gynecol。2008;111(1):231 - 41。
确认
朱拉隆功国王纪念医院妇科诊所和性别健康诊所的医务人员、护士和辅助人员都参与了这项研究。
资金
这项研究是由朱拉隆功大学医学院的Ratchadapiseksompotch基金资助的。
作者信息
从属关系
贡献
协议开发,数据收集,数据分析,手稿撰写/编辑。方案开发,数据分析,手稿撰写/编辑。制定方案,分析数据。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
这项研究得到了朱拉隆功大学医学院机构审查委员会的批准,irb009 /62。在研究开始前,所有参与者均获得书面知情同意。这项研究中涉及人类参与者的所有程序都符合机构和国家研究委员会的伦理标准,并符合1964年《赫尔辛基宣言》及其后来的可比伦理标准。
同意出版
不适用。
相互竞争的利益
本研究的所有作者声明他们之间没有利益冲突。
补充资料
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非数据信用额度中另有规定。
关于这篇文章
引用这篇文章
Vatrasresth, J, Suwan, A. & Panyakhamlerd, K.早期戊酸雌二醇给药对手术诱导的绝经妇女骨转换标志物的影响。BMC妇女健康21,363 (2021). https://doi.org/10.1186/s12905-021-01508-w
收到了:
接受:
发表:
关键字
- 外科更年期
- 骨转换标记物
- 血清CTX
- 血清P1NP
- 雌二醇戊酸酯